Inmunoterapia “inyectable” contra el cáncer: cómo funciona este nuevo tratamiento aprobado en Argentina
Se trata de una nueva inmunoterapia inhibidora de PD-1 que cambia la forma tradicional con quimioterapia de tratar esta enfermedad, ofreciendo la misma eficacia vía intravenosa.
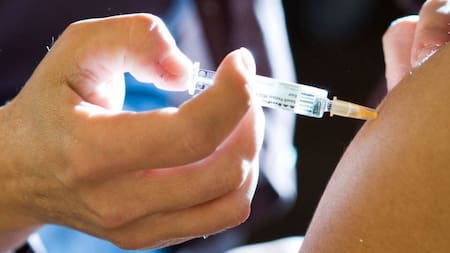
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) aprobó en Argentina la primera inmunoterapia inhibidora de PD-1 de administración subcutánea para el tratamiento de tumores sólidos en adultos, una decisión que marca un avance en el abordaje del cáncer y que podría tener un enorme impacto tanto en la experiencia de los pacientes como en la organización de los servicios de salud.
La autorización fue difundida en Buenos Aires en febrero de 2026 y coincidió con el Día Mundial del Cáncer, que se conmemora cada 4 de ese mes.
Según datos de la Organización Mundial de la Salud (OMS), el cáncer provoca alrededor de 10 millones de muertes por año en todo el mundo y se diagnostican cerca de 20 millones de nuevos casos. En Argentina, la carga de la enfermedad también es elevada, con más de 130.000 diagnósticos anuales.

Cómo funciona el nuevo fármaco contra el cáncer
El nuevo fármaco aprobado por ANMAT en Argentina suma una tendencia que avanza en materia de oncología: las inmunoterapias administradas por vía subcutánea, es decir, mediante una inyección debajo de la piel. Y aunque no se trata de un cambio en la efectividad del tratamiento, si modifica la forma de administración.
La novedad radica en que reemplaza la infusión intravenosa —que requiere hospital de día y acceso venoso— por un procedimiento más simple y rápido. La aprobación tiene que ver con la primera inmunoterapia inhibidora de PD-1 de administración subcutánea para adultos con tumores sólidos, entre los que se pueden tratar los siguientes:
- Cáncer de pulmón metastásico
- Cáncer renal avanzado
- Cáncer gástrico
- Melanoma
- Tumores de esófago
- Cáncer colorrectal con inestabilidad de microsatélites
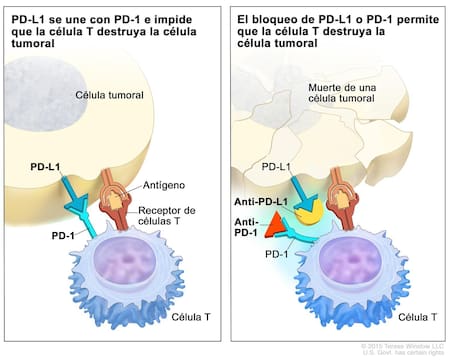
Este tipo de tratamiento no ataca directamente al tumor como lo hace la quimioterapia tradicional. En cambio, estimula al propio sistema inmunológico para que reconozca y combata las células cancerosas. Algunos tumores utilizan “señales de camuflaje” para evitar ser detectados por las defensas del organismo. Una de esas señales es la proteína PD-1 (Programmed Death-1), que actúa como un freno del sistema inmune.
El fármaco aprobado bloquea esa señal. Al inhibir PD-1, elimina el “escudo” que protege al tumor y permite que las células inmunes lo identifiquen y lo ataquen.
Este cambio, aparentemente operativo, puede tener efectos concretos en la práctica clínica cotidiana. La vía subcutánea elimina la necesidad de acceso venoso, un aspecto especialmente relevante en pacientes oncológicos que suelen atravesar tratamientos prolongados. Al no requerir acceso venoso, evita el uso de catéteres y simplifica la experiencia tanto para los pacientes como para los médicos.
La decisión de ANMAT se sustenta en evidencia clínica sólida. Estudios realizados en distintos países, incluida Argentina, demostraron que la formulación subcutánea alcanza los objetivos de exposición farmacocinética y presenta perfiles de eficacia y seguridad comparables a los de la versión intravenosa. Estos resultados fueron evaluados en el estudio fase III CheckMate-67T, que incluyó a 495 pacientes con carcinoma de células renales avanzado o metastásico previamente tratados.

La participación argentina en ese ensayo fue especialmente relevante: 167 pacientes fueron tratados en ocho instituciones médicas del país, lo que representa más del 33% del total de participantes a nivel mundial. Este aporte refuerza el rol de los centros locales en la investigación clínica internacional y en la generación de evidencia para nuevas terapias oncológicas.
Más allá del beneficio clínico, la incorporación de inmunoterapias subcutáneas también abre la puerta a mejoras en la gestión de los recursos sanitarios. Estimaciones realizadas en sistemas de salud internacionales, como el del Reino Unido, indican que este tipo de formulaciones podría liberar alrededor de 1.000 horas mensuales de atención combinada entre pacientes, personal de enfermería, farmacia y médicos, un volumen equivalente a más de un año completo de tiempo de atención acumulado.